Triely (skupina boru)
Hlavní záložky
1. Elektronová konfigurace p1-prvků
Označení p1-prvky znamená, že 1 valenční elektron (ten, který se nachází v nejvzdálenější obsazené - valenční - vrstvě od jádra) těchto prvků se nachází v orbitalu typu p.
Elektronová konfigurace p1-prvků je tedy: [VP] ns2 np1
(VP... vzácný plyn n ... číslo periody, kde se daný prvek nachází)
Všechny p1-prvky se souhrnně označují pojmem triely (skupina boru). Tyto prvky se vyskytují buď ve 3. oxidačním stavu (BIII, AlIII...) či 1. (TlI). Bor jako jediný patří mezi polokovy, ostatní prvky (hliník, galium, indium, thalium) jsou kovy. Borité soli barví plamen intenzivně zeleně. Nejvýznamnějšími dvěma prvky této skupiny jsou bor a hliník.
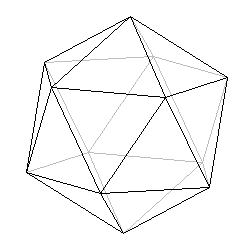
Bor má vysokou teplotu tání i varu a je značně tvrdý, což je způsobeno uspořádáním jeho atomů do tvaru pravidelného ikosaedru B12. Tento geometrický útvar je tvořen 12 vrcholy (atomy boru) a 20 trojúhelníkovými plošinami - proto označení ikosaedr (ikosa = 20).

Hliník je velmi lehký kovový prvek, vyznačuje se vysokou kujností (vylisovaný do tenké folie se nazývá alobal), patří mezi značně reaktivní prvky, avšak na běžném vzduchu se snadno pokrývá vrstvou svého oxidu zabraňující dalším reakcím. Vede teplo i elektřinu.
Kvůli vysoké reaktivitě se p1-prvky nevyskytují v přírodě v elementární podobě. Bor je vázaný například v minerálu borax Na2B4O7 ∙ 10 H2O či v kyselině borité HBO2, která je v malém množství obsažena v sopečných plynech. Nejvýznamnějšími minerály hliníku jsou korund Al2O3 a bauxit Al2O3 • 2 H2O. Odrůdami korundu jsou například safír (modrý), rubín (červený), smaragd (zelený) a topas (žlutý).




Pro výrobu p1-prvků lze využít redukce z jejich oxidů (B2O3, Al2O3...). Hliník se však průmyslově vyrábí elektrolýzou tavenin bauxitu Al2O3 • 2 H2O. Předem připravený bauxit se ve směsi s kryolitem Na3[AlF6] (snižuje teplotu tání směsi z 2.050 °C na 950 °C ) nasype do elektrolyzéru, ve kterém se začne vylučovat na katodě elementární hliník a na anodě kyslík, který ihned reaguje s grafitem (materiálem elektrody) za vzniku oxidu uhelnatého.
V elementární podobě nachází uplatnění pouze hliník. Dříve se využíval pro výrobu příborů, nádobí a dalších kuchyňských potřeb. Ve vylisované podobě, jako alobal, slouží jako izolant ohřátých potravin či při barvení vlasů. Kromě toho se v práškové podobě využívá jako složka některých pyrotechnických směsí či prskavek.
6. Chemické vlastnosti hliníku
Práškový hliník po zapálení shoří na bílý oxid hlinitý:
4 Al + 3 O2 → 2 Al2O3
Čistý hliník reaguje s vodou za vzniku hydroxidu hlinitého a uvolnění vodíku:
2 Al + 6 H2O → 2 Al(OH)3 + 3 H2
Reakcí hliníku s kyselinou vzniká hlinitá sůl a vodík:
2 Al + 6 H+ → 2 Al3+ + 3 H2
2 Al + 6 HCl → 2 AlCl3 + 3 H2
S hydroxidem reaguje hliník za vzniku komplexní sloučeniny a uvolnění vodíku:
2 Al + 2 OH- + 6 H2O → 2 [Al(OH)4]- + 3 H2
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
![]()
"Připravíme si čtverečky alobalu o rozměrech 0,5 x 0,5 cm a uděláme z nich drobné kuličky. Dále si nachystáme dvě kádinky (100 ml) a do každé vhodíme 10 ks takto připravených kuliček. Do první kádinky přilijeme 20 ml 10 % kyseliny chlorovodíkové a do druhé stejný objem 10 % hydroxidu sodného. Pozorujeme průběh reakcí v obou kádinkách" Hliník se využívá jako redukční činidlo při získávání kovů z jejich solí - tuto reakci nazýváme aluminotermie. Hliník se při reakci oxiduje:
Al0 - 3 e- → Al3+
2 Al + Fe2O3 → 2 Fe + Al2O3
![]()
"Do květináče nasypeme 7,5 g oxidu železitého a 2,5 g práškového hliníku. Připravenou směs pomocí tyčinky důkladně promícháme. Zapálíme kahan a do jeho plamene vložíme hořčíkovou pásku. Jakmile páska vzplane, vhodíme ji do květináče se směsí. Po ukončení chemické reakce přiložíme k produktu magnet."


