Teorie acidobazických reakcí
Hlavní záložky
1. Obecná charakteristika acidobazických reakcí
Acidobazické reakce (protolytické reakce) jsou reakce kyselin a zásad. Rozdělení látek na kyselé a zásadité má svoje historické opodstatnění, zatímco nejprve byly definovány podle své chuti (tzn. že kyseliny jsou kyselé), později tuto charakteristiku nahradily nové, praktičtější teorie. V současnosti jsou jako acidobazické reakce chápány ty, při kterých dochází k přesunu (transportu) protonů H+, a to nejčastěji ve vodném prostředí.
Nejstarší novodobou teorii definující kyseliny a zásady navrhnul švédský chemik Svante Arrhenius. Ten označil kyseliny za látky, které ve vodném prostředí odštěpují protony H+:
HCl → H+ + Cl-
H2SO4 → 2 H+ + SO42-
Zásady dle Arrheniovy teorie odštěpují hydroxylový anion OH-:
NaOH → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
Jelikož Arrhenius považoval za zásady pouze hydroxidy a jeho teorii bylo možné použít jen na vodné roztoky, byla o několik let později navržena nová koncepce – Brönsted-Lowryho teorie kyselin a zásad (mnohdy uváděna jen jako Brönstedova teorie). Dánský chemik Johannes Nicolaus Brönsted označil nezávisle na jeho anglickém kolegovi Thomasu Martinovi Lowryn kyseliny za látky odštěpující protony H+ (stejně jako tomu bylo u Arrheniovy teorie) a zásady za látky protony H+ přijímající.
HNO3 → H+ + NO3-
NH3 + H+ → NH4+
Samotný proton H+ se ve vodném prostředí nemůže vyskytovat, dochází k jeho hydrataci. Tento fakt lépe vystihuje zápis H3O+. Ve vodném roztoku kyseliny dusičné dochází tedy k následujícímu štěpení:
HNO3 + H2O → H3O+ + NO3-
Mezi molekulami a vzniklými ionty se často ustanovuje dynamická rovnováha, a tak zapisujeme tyto reakce jako rovnovážné. Při hydrolýze (například) kyseliny jodovodíkové dochází k následné disociaci:
HI + H2O ↔ I- + H3O+
Společně se zavedením Brönsted-Lowryho je vhodné zavést také pojem konjugovaný pár. Jedná se o dvojici dvou částic lišících se o jeden proton H+. Chemickou reakci pak můžeme rozložit na rovnice přeměn dvou konjugovaných párů:

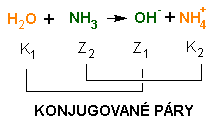
Experimentálně bylo zjištěno, že i mezi molekulami vody dochází k její částečné disociaci. Tomuto jevu říkáme autoprotolýza vody:

Z měření vyplynulo, že koncentrace oxonionových kationtů H3O+ je shodná s koncentrací hydroxylových aniontů OH-. Koncentrace obou iontů je při teplotě 25 °C a tlaku 100 kPa 10-7 mol•dm-3. Vynásobením koncentrací kationtů H3O+ a aniontů OH- získáme iontový součin vody KV (platný pro danou teplotu a tlak):
KV = [H3O+]•[OH-] = [10-7]•[10-7] = [10-7]2 = 10-14
3.1.1 Vyjadřování kyselosti a zásaditosti látek
Pro vodné roztoky látek se stanovuje jejich kyselost a zásaditost. Je-li koncentrace kationtů H3O+ vyšší než koncentrace aniontů OH-, je roztok kyselý. V případě, že převládají anionty OH- nad kationty H3O+, hovoříme o roztocích zásaditých. Pokud se nachází oba ionty v rovnováze, je roztok neutrální.
Jelikož práce s malými čísly je velice nepraktická, zavedli vědci tzv. pVeličiny. Kde písmenko „p“ před veličinou udává její záporný dekadický logaritmus. Proto pH je veličina udávající záporný dekadický logaritmus koncentrace oxoniových kationtů H3O+:
pH = - log [H3O+]
Hodnotu pH počítáme u vodných roztoků kyselin, zásad a jejich solí.
3.1.3.1 Výpočet pH silných kyselin
Silné kyseliny jsou takové, jejichž hodnota disociační konstanty KA (viz Chemická rovnováha) je větší než 10-2. Molekuly silných kyselin jsou ve vodném prostředí zcela rozštěpeny (disociovány) na oxoniové kationty H3O+ a anionty dané kyseliny:
HX + H2O → H3O+ + X-
Koncentrace jednosytné kyseliny (má jeden odštěpitelný vodíkový atom) se tedy rovná koncentraci oxonionových kationtů H3O+.
|
Jaké je pH kyseliny chlorovodíkové HCl (KA = 1,3•106), jestliže je její koncentrace 0,001 mol•dm-3? HCl + H2O → H3O+ + Cl- pH = - log [H3O+] = - log [HCl] = - log 0,001 = 3 Hodnota pH kyseliny chlorovodíkové o dané koncentraci je 3. |
|
Jaké je pH kyseliny sírové H2SO4 (KA = 103), jestliže je její koncentrace 5•10-3 mol•dm-3? H2SO4 + 2 H2O → 2 H3O+ + SO42- pH = - log [H3O+] = - log 2•[H2SO4] = - log 10-2 = 2 Hodnota pH kyseliny sírové o dané koncentraci je 2. |
Obsahuje-li kyselina více atomů vodíku, nazýváme ji vícesytnou (dvojsytnou, troj-…) a tímto počtem násobíme její koncentraci.
3.1.3.2 Výpočet pH slabých kyselin
Jestliže je hodnota disociační konstanty kyseliny KAmenší než 10-2, pak patří daná kyselina mezi slabé. V přípradě disociační konstanty menší než 10-9 hovoříme o kyselinách velmi slabých. Ve vodných roztocích slabých kyselin existují oxonionové kationty H3O+ a anionty daných kyseliny společně s molekulami kyseliny a vody. Proto se koncentrace oxonionových kationtů nerovná koncentraci kyseliny. Hodnota pH se poté vypočítá ze vztahu: pH = ½ • (pKA – log [HX]) přičemž: pKA = -log KA
|
Jaké je pH kyseliny octové CH3COOH (KA = 1,75•10-5), pokud je její koncentrace 0,2 mol•dm-3? CH3COOH + H2O ↔ H3O+ + CH3COO- pKA = -log KA = - log 1,75•10-5 = 4,757 pH = ½ • (pKA – log [HX]) = ½ • (4,757 – log 0,2) = 2,73 Hodnota pH kyseliny octové o dané koncentraci je 2,73. |
|
Jaké je pH kyseliny trihydrogenfosforečné H3PO4 (pKA = 2,12), jestliže je její koncentrace 0,15 mol•dm-3? H3PO4 + 3 H2O ↔ 3 H3O+ + PO43- pH = ½ • (pKA – log [HX]) = ½ • (2,12 – log 0,15) = 1,47 Hodnota pH kyseliny fosforečné o dané koncentraci je 1,47. |
Hodnota pKA je rovněž tabulková a může být zadána kdykoliv stejně tak, jako hodnota KA. Vzájemný vztah mezi těmito veličinami je následující: pKA = - log KA KA =
3.1.3.3 Výpočet pH silných zásad
Při výpočtu pH silných zásad (majících pKb > 10-2), postupujeme obdobně, jako při výpočtu pH silných kyselin. Záporný dekadický logaritmus koncentrace hydroxylových aniontů OH- je ale roven hodnotě pOH, ze které vypočítáme pH ze vztahu:
pH = 14 – pOH
|
Jaké je pH hydroxidu sodného NaOH (pKB = 0,1), jehož koncentrace je 0,1 mol∙dm-3? NaOH ↔ Na+ + OH- pOH = - log [OH-] = - log 0,1 = 1 pH = 14 – 1 = 13 Hodnota pH hydroxidu sodného o dané koncentraci je 13. |
|
Jaké je pH hydroxidu vápenatého Ca(OH)2, jehož koncentrace je 0,0005 mol∙dm-3? Ca(OH)2 ↔ Ca2+ + 2 OH- pOH = - log 2[OH-] = - log 2 [0,0005] = - log 0,001 = 3 pH = 14 - 3 = 11 Hodnota pH hydroxidu vápenatého o dané koncentraci je 11. |
3.1.3.4 Výpočet pH slabých zásad
Jestliže je hodnota disociační konstanty zásady KB menší než 10-2, pak patří daná zásada mezi slabé. V přípradě disociační konstanty menší než 10-9 hovoříme o zásadách velmi slabých. Ve vodných roztocích slabých zásad existují hydroxidové anionty OH- a kationty daných kovů (z společně s molekulami zásady a vody. Proto se koncentrace hydroxidových aniontů nerovná koncentraci zásady.
Hodnota pH se poté vypočítá ze vztahu:
pH = 14 - ½ • (pKB – log [MOH])
přičemž:
pKB = -log KB
Při výpočtech pH solí musíme nejprve rozhodnout, zda pochází ze silné nebo slabé kyseliny či zásady. Napomoci nám k tomu může disociační konstanta dané sloučeniny.
Pufry jsou tlumící roztoky, které zmírňují prudké změny pH po přilití silné kyseliny či zásady do vzorku látky. Tyto roztoky jsou tvořené buď směsí slabé kyseliny a její soli se silnou zásadou (např. kyselina octová CH3COOH a octan sodný CH3COONa), anebo směsí slabé zásady a její soli se silnou kyselinou (např. amoniak NH3 a chlorid amonný NH4Cl).
Jako zcela nejobecnější teorie je v současnosti vnímána teorie amerického fyzika Gilberta Newtona Lewise, který definoval kyselinu jako látku s volným valenčním orbitalem (elektrofil) a zásadu jako látku s volnými valenčními elektrony (nukleofil). S ohledem na tento koncept se dané látky označují jako Lewisovy kyseliny, eventuélně Lewisovy zásady. Při takto obecném pojetí acidobazicity můžeme na vznik koordinačně-kovalentní vazby pohlížet jako na reakci Lewisovy kyseliny (centrální atom) s Lewisovou bází (ligand).


