Periodický zákon a jeho autor
Hlavní záložky
Dne 6. března 1869 prezentoval ruský chemik Dmitrij Ivanovič Mendělejev periodický zákon, který formuloval na základě pozorování, že vlastnosti mnohých prvků jsou si podobné a tato charakteristika se pravidelně opakuje.
|
,,Vlastnosti prvků jsou periodickou vlastností jejich protonového čísla.‘‘ |
1. Periodicky se opakující vlastnosti prvků
Podstatu periodického zákona si vysvětlíme na velmi jednoduchém příkladu – alkalických kovech, prvcích I.A skupiny periodické soustavy prvků vyjma vodíku. Do této skupiny řadíme lithium 3Li, sodík 11Na, draslík 19K, rubidium 37Rb, cesium 55Cs a francium 87Fr. Všechny tyto prvky mají ve své valenční vrstvě pouze jeden elektron. Jejich společné vlastnosti jsou například:
- měkké (lze je krájet nožem), stříbrolesklé
- vysoká reaktivita, bouřlivé reakce například s halogeny
- snadná oxidace na běžném vzduchu (uchovávají se například pod petrolejem)
- bouřlivá reakce s vodou (za vzniku hydroxidu a vodíku)
- zásadotvornost
Jednotlivé vlastnosti chemických prvků se projevují různě intenzivně dle rostoucího či klesajícího protonového čísla (např. reaktivita alkalických kovů roste od lithia k franciu, zatímco v opačném směru roste jejich elektronová afinita).
![]()
"Připravíme si 3 keramické síťky a 3 krystalizační misky naplněné do poloviny jejich objemu vodou. Pomocí pinzety vyjmeme ze zásobních lahví s petrolejem kousek lithia, sodíku a draslíku a každý kov dáme na jednu ze sítěk. Nožem zkusíme jednotlivé kovy rozříznout. Do první krystalizační misky s vodou vhodíme kousek lithia, do druhé sodíku a do poslední draslíku. Pozorujeme probíhající reakce v miskách a po jejich skončení přidáme do každé misky 3 kapky fenolftaleinu."
2. Vlastnosti vyplývající z periodické soustavy
Z periodické soustavy prvků lze snadno určit, jak v ní vzrůstá či klesá reaktivita, elektronegativita, kovový charakter (atd.) jednotlivých prvků.

Obr.: Směr růstu elektronegativity a nekovového charakteru
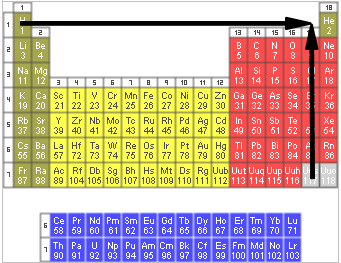
Obr.: Směr růstu ionizační energie a elektronové afinity

Obr.: Směr růstu velikosti atomových poloměrů
3. Dmitrij Ivanovič Mendělejev
Narodil se v Tobolsku na Sibiři, kde ve sklárně své matky mohl jako chlapec obdivovat výsledky praktické chemie. S úžasem tehdy pozoroval, jak vzniká sklo a jak různé příměsi ovlivňují jeho vlastnosti. Bezstarostné dětství však bylo přerušeno katastrofou. Sklárna vyhořela a matka se upnula k jedinému cíli - poskytnout svému nejmladšímu synovi dobré vzdělání. Podnikla s ním cestu do Petrohradu, kde se Mendělejev zapsal na univerzitě. Po jejím úspěšném absolvování pracoval v Heidelbergu v laboratořích slavného německého chemika Roberta Wilhelma Bunsena. Když se roku 1867 vrátil do Ruska, stal se profesorem chemie na petrohradské univerzitě. Když ministr školství odmítl přiznat univerzitě akademickou svobodu, na protest z ní odešel. Téhož roku vynalezl nový druh bezdýmého prachu. Mendělejev se bez povolení pravoslavné církve podruhé oženil. Když se na podvod přišlo, car mu udělil milost a na stížnost jednoho knížete, proč jemu nebyla povolená stejná výjimka odpověděl: ,,Mám mnoho šlechticů, ale jen jednoho Mendělejeva.'' Od roku 1892 až do své smrti působil Mendělejev jako ředitel ruského Úřadu pro míry a váhy. V jeho době bylo známo asi 65 prvků. Nejmenší částečku prvku chemici nazývali atom, jeho vlastnosti byly podstatou chemických vlastností každého prvku. Bylo zřejmé, že atomy se odlišují především svou váhou. Mendělejev uvažoval, zda by očividně velmi odlišné vlastnosti prvků kovových a nekovových mohly nějak souviset s váhou jejich atomu. Roku 1869 vyšel v časopise Ruská chemická společnost článek, v němž Mendělejev poprvé vyložil svůj systém uspořádávání prvků podle jejich atomové hmotnosti. Na první místo dal nejlehčí vodík, jako poslední uran, tehdy nejtěžší známý prvek. Mendělejev rovněž v mezerách v tabulce předpověděl existenci dosud neobjevených prvků. A dokonce popsal jejich možné vlastnosti. V Rusku vešla tabulka ve známost jako ,,Mendělejevova tabulka''. Řád, který Mendělejev vnesl do množství postupně objevovaných prvků, otevřel chemikům a fyzikům oči. Mimo jiné se jejich pozornost upnula k uranu - poslednímu v tabulce. Mendělejevova genialita je v dějinách vědy něčím zcela nevídaným. Nejenže jeho tabulka přestála veškeré kritické útoky, ale jeho předpovědi byly vždy znovu a znovu potvrzovány pozdějšími objevy nových prvků, a to i mnoho let po jeho smrti. Nejslavnější je historie objevu gallia. Mendělejev do mezery mezi vápník a titan umístil prvek, zvaný ekaaluminium. Ten o šest let později, roku 1875, objevil francouzský chemik Lecoq de Boisbaudran a nazval jej gallium. Krátce poté poslal Mendělejev objeviteli dopis, v němž jej upozorňoval, že měrná hmotnost gallia nemůže být 4,7, jak francouzský chemik experimentálně určil, nýbrž se musí pohybovat mezi 5,9-6,0. Lecoq se dost podivil troufalosti vědce, který jeho gallium nikdy neviděl, a přesto se odvažuje o něm tak zasvěceně mluvit. Jaké však bylo jeho překvapení, když při opakovaných pokusech měrnou hmotnost gallia opravdu určil na 5,96. Tato senzační Mendělejevova předpověď se rychle rozšířila ve vědeckých kruzích a jeho periodický zákon triumfoval - poprvé, ale nikoli naposledy. Mendělejev byl originálním myslitelem i tehdy, když se mýlil: Kupříkladu předpokládal, že existují dva vzácné plyny, které mají menší atomovou hmotnost, než vodík, a nazval je koronium, což měla být součást sluneční koróny, a newtonium, světelný éter pronikající veškerou hmotou.
[Zdroj: Galerie géniů I - 222 osobností, které změnily svět (V. Haškovec, O. Müller)]


