Chemické prvky
Hlavní záložky
1. Částicové složení chemických prvků
Jako chemický prvek označujeme skupinu atomů, které mají shodný počet protonů (tedy protonové číslo). Z experimentů bylo zjištěno, že atom se navenek chová jako elektricky neutrální částice. Vzhledem k tomu, že proton i elektron jsou částice nesoucí elektrický náboj (náboj je nazýván jako elementární) stejné velikosti, ale opačného znaménka, můžeme usoudit, že atom obsahuje stejný počet protonů a elektronů. Pokud mají atomy daného prvku vždy stejný počet neutronů (shodné neutronové, a tak i nukleonové číslo), jedná se o jeho nuklid. Pokud jsou počty neutronů u prvku rozdílné, považujeme jednotlivé atomy za izotopy.
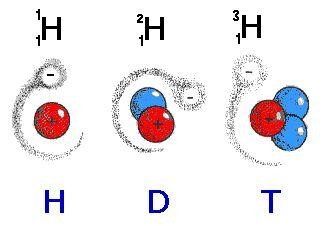
Obr.: Izotopy vodíku - červeně jsou zobrazeny protony, modře neutrony a bíle elektrony. Jednotlivé izotopy se nazývají (zleva) protium, deuterium a tritium. Protium se značí H (vodík), deuterium a tritium svými počátečními písmeny.
2. Klasifikace chemických prvků
Chemické prvky je možné klasifikovat dle různých kritérií. Starší klasifikace vyplynula z pozorování podobných vlastností jistých prvků, prvky podle ní dělíme na kovové (kovy), nekovové (nekovy) a přechodnou skupinu mezi těmito mezními skupinami tvoří polokovy.

Obr.: Periodická soustava prvků s vyznačenými kovy (modře), nekovy (zeleně) a polokovy (růžově).
Modernějším způsobem klasifikace je dělení na základě struktury elektronového obalu na prvky bloku s, p, d a f.
3. Vlastnosti chemických prvků
Každý chemický prvek můžeme charakterizovat jeho fyzikálními (hustota, bod tání a varu, elektronová konfigurace, ionizační energie...) i chemickými (reakce s ostatními prvky či sloučeninami ...) vlastnostmi. Tyto vlastnosti se pravidelně (periodicky) opakují v rámci jednotlivých skupin periodické soustavy prvků.


